글로벌 제약사 BMS가 CD19 CAR-T ‘BMS-986353’의 전신홍반성루푸스(SLE) 임상1상에서 증상을 개선한 예비분석 결과를 내놨다.
혈액암 치료제로 사용되던 CD19 CAR-T의 자가면역질환으로 확장가능성을 보여주는 데이터다.
전신홍반성루푸스 환자서 “유망한 효능과 안전성 보여”
15일 업계에 따르면 BMS는 CD19 CAR-T ‘BMS-986353’의 임상1상(NCT05869955)의 업데이트된 결과를 미국 류마티스학회(American college of rheumatology, ARC)에서 17일(현지시간) 발표할 예정이다.
학회 초록에 따르면 분석시점(6월) 기준으로 9명의 환자가 임상에 등록됐다. 이들은 이전에 다양한 치료법(범위 5~8회)으로 치료받았음에도 질병이 진행됐다. 이중 전신홍반성루푸스(SLE) 환자 4명이 BMS-986353으로 치료받았다.
임상에 참여한 환자는 BMS-986363 저용량(10×106 cells 또는 25×106 cells)로 치료받았다. 이번 결과는 저용량군을 대상으로 분석한 데이터다.
분석결과 BMS는 BMS-986353의 안전성과 SLE 증상개선을 확인했다.
먼저, BMS-986353으로 치료받은 환자에게서 신경독성, 중증부작용(SAE), 용량제한독성(DLT)은 보고되지 않았다. BMS-986353 투여후 1등급 사이토카인방출증후군(CRS)이 보고됐으나 사이토카인 억제요법이나 스테로이드 요법 없이 하루만에 해소됐다. 3~4등급 부작용으로 림프구고갈요법 관련 혈구감소증(lymphodepletion-related cytopenia)가 3명(75%)에서 나타났다.
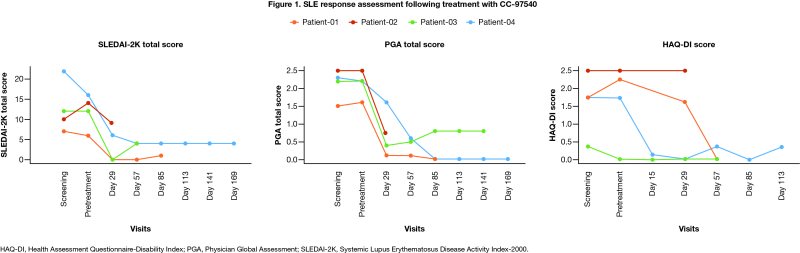
루푸스 치료를 중단했음에도 불구하고, 모든 환자는 SLE의 증상을 분석하는 지표인 SLEDAI(Systemic Lupus Erythematosus Disease Activity Index) 점수, PGA(Physician Global Assessment), HAQ-DI(Health Assessment Questionnaire-Disability Index)에서 개선되는 결과를 보였다. 또한 신규 질병활성 징후 없이 치료효과가 유지됐다.
SLEDAI는 루푸스의 질병상태와 염증을 분석해 질병활성도를 정량적으로 평가하는 지표다. PGA는 의료진이 환자의 전반적인 질병상태를 종합적으로 분석하는 지표이며, HAQ-DI는 환자의 일상생활 기능과 장애정도를 평하는 지표다.
또한 약력학적분석(PD) 결과, 2명의 환자에게서 완전한 B세포 제거(depletion)을 보였다. 나머지 1명의 환자는 B세포가 제거후 다시 재증식됐으나, 질병활성의 증거없이 치료효과가 지속됐다.
B세포는 병원성 자가항체 생산, 자가반응성 T세포 활성화 등 면역반응을 과활성화해 자가면역질환을 유발한다. B세포 고갈은 체내 면역시스템을 재설정해, 전신홍반성루푸스(SLE)를 포함한 자가면역질환의 증상을 개선하는 것으로 알려졌다.
BMS-986353은 제조시간을 기존 3주에서 7일 미만으로 단축하고, CAR-T 약물의 효능과 내구성을 최적화하는 기술인 NEX-T 플랫폼을 기반으로 생산된다.
BMS 측은 “저용량의 BMS0986353 투여군에서 유망한 효능과 안전성 예비데이터를 보였다”며 “또한 강력한 CAR-T 증식과 완전한 B세포 제거효과를 나타냈다”고 말했다.
한편, 큐로셀이 ‘BMS-986353’의 전신홍반성루푸스(SLE) 임상1상 예비분석 결과로 인해 주목받을 전망이다.
연내 혈액암을 적응증으로 신약허가를 신청할 것으로 알려진 큐로셀의 ‘안발셀(anbal-cel)’은 면역관문억제제인 PD-1과 TIGIT의 발현을 억제하는 OVIS(Overcome Immune Suppression) 기술이 적용된 CD19 CAR-T다. 큐로셀은 안발셀의 후속 적응증을 SLE로 확대할 계획인 것으로 알려졌다.