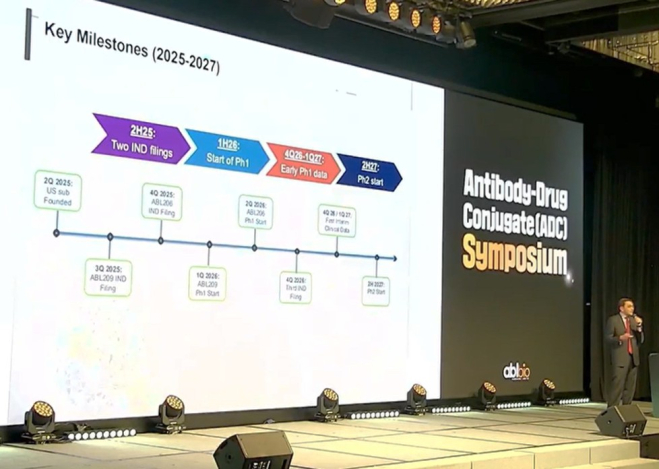
“올해 하반기까지 이중항체 항체-약물접합체(ADC) 2건의 임상시험계획(IND)을 미국 식품의약국(FDA)에 제출하고 내년 1분기부터 임상을 시작하는 것이 목표”
마얀크 간디(Mayank gandhi) 에이비엘바이오 미국법인 CEO는 14일 JW메리어트 호텔 서울 그랜드볼룸에서 열린 '2025 ADC 심포지엄'에서 이같이 밝혔다.
그는 “확보한 자금을 이용해 신속하게 개발하는 것이 상업적 성공을 위해 중요하다”고 강조했다.
이날 처음 모습을 보인 간디 CEO는 에이비엘바이오의 미국 법인 대표로 최근 선임됐다. 오는 4월부터 정식으로 취임할 예정이다. 취임후 이중항체 ADC 개발을 주도하는 미국 법인을 이끈다. 그는 제넨텍(Genetech)에서 20년 이상 근무한 신약개발 전문가다. 제넨텍에서 PD-L1 항체 ‘티쎈트릭(Tecentriq)’ 개발에 관여했다.
또한 제약바이오분야 애널리스트로 근무했으며, 합류직전에는 항암제 개발 바이오텍인 이펙터 테라퓨틱스(eFFCTOR Therapeutics)에서 최고비즈니스사업자(CBO)로 근무했다.
이상훈 에이비엘바이오 대표는 미국 법인에 이사진으로만 참여하며, 두 회사는 독립적으로 운영될 계획이다.
가장 먼저 IND를 제출할 에셋은 ‘ABL209’로 1+1 형태의 이중항체 ADC다. 타깃은 공개하지 않았다.
페이로드는 엑사테칸(exatecan) 기반의 TOP1 저해제를 사용했다. 약물항체비율(DAR)은 4개다. 해당 페이로드는 시나픽스로부터 지난 2023년 도입한 것이다.
이중항체 ADC인 ABL209는 각각의 표적에 대한 단일항체ADC 대비 향상된 세포내 유입(internalization) 능력을 보였다. 암세포내 더 잘 침투된다는 의미다.
또한 다양한 고형암을 이용한 마우스모델(PDX model)에서 단일항체ADC와 비교해 더 효과적종양성장 억제효과를 나타냈다.
간디 CEO는 “다양한 암종에 걸쳐서 항암효과를 보여 광범위한 적응증에 적용가능 할 것으로 기대된다”고 말했다.
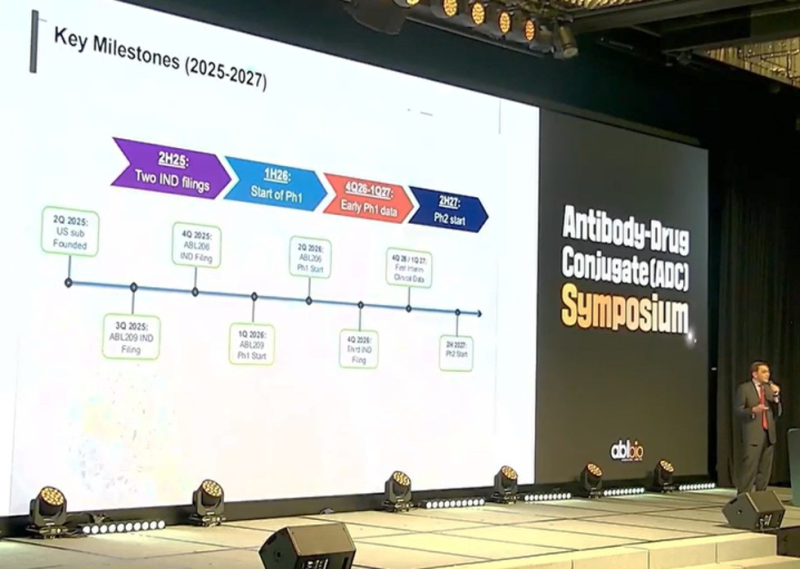
에이비엘바이오는 ABL209를 폐암, 췌장암, 대장암, 두경부암 등의 고형암을 적응증으로 개발할 계획이다. ABL209는 올해 4분기 FDA에 IND를 신청하는 것이 목표다.
ABL206은 2+2 구조의 이중항체 ADC다. 비소세포폐암, 난소암, 삼중음성유방암, 전립선암 등을 적응증으로 한다. 구체적인 타깃은 공개하지 않았다.
ABL209처럼 시나픽스에서 도입한 TOP1 저해제를 페이로드로 사용했다. DAR은 4개다.
ABL206은 전임상 연구에서 각각의 단일항체 ADC와 비교해 더 높은 표적 결합력과 세포내유입 능력을 보였다.
또한 폐암과 난소암 마우스모델(CDX)에서 단일항체ADC와 비교해 우수한 항암효과를 나타냈다. 종양성장억제효과(Tumor growth inhibition)도 다양한 암모델(PDX)에서 보여 광범위한 적응증에 사용가능성을 엿보였다.
에이비엘바이오는 ABL206을 올해 4분기 FDA에 IND를 신청할 계획이다. 임상1상 개시는 내년 2분기로 계획중이다.
간디 에이비엘바이오 미국법인 CEO는 “내년말까지 임상1상 데이터를 확인하고 2027년 1분기 임상2상 진입이 목표”라며 “3번째 이중항체ADC는 내년 4Q 임상시험계획(IND) 제출을 계획중”이라고 설명했다.